作者 | 《财经》特派香港记者 焦建 编辑 | 苏琦
随着相关机制的建立及成熟,国际药械经中国香港审批后,有机会经“药械通”机制进入粤港澳大湾区市场;中国内地药企创新药亦能通过中国香港积极打入国际市场
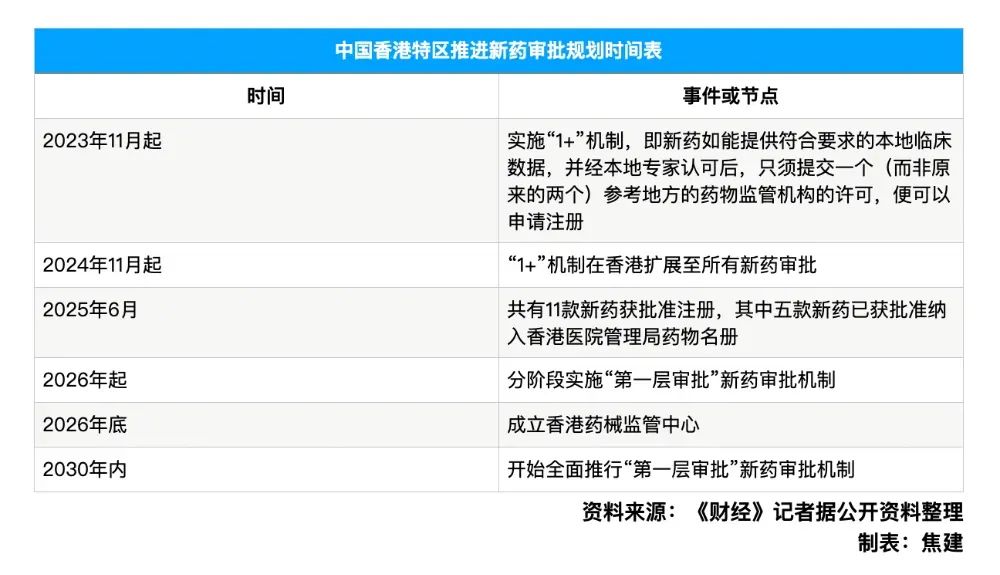
6月26日,按照中国香港特区政府卫生署当日正式对外公布的一份时间表显示,当地将从2026年起分阶段推行“第一层审批”新药注册机制。与之相应的执行机构,则是一个名为“香港药物及医疗器械监督管理中心”的新机构,也将于2026年底前成立。
此举被多方认为将标志着中国香港特区在医疗监管、药物自主审批和产业创新迈出关键一步。究其意义,相关机制及机构将有助于中国香港进一步掌握药物研发与注册的主动权,提升医药产业优势,为中国内地药企走出去和国际药企引进来发挥“超级联系人”角色。
正在筹备成立的香港药物及医疗器械监督管理中心,在当地亦被简称为药械监管中心,其英文缩写为CMPR,该中心将分为药物、中医药规管和健康科学及科技三个办公室。为赋予该中心监管西药和中药的法定权力等,中国香港特区将进行立法。
在此之前,在处理新药注册申请时,中国香港特区采用“第二层审批”或“2+”制度,即必须首先获得两个外国的权威机构审批认可,所谓第一层审批。在此基础上,再由中国香港特区卫生署进行第二层审批,在审视相关数据并确保药物安全等方面经过严谨审查后,才可在中国香港销售或供应。
整个过程耗时相对较长,往往需要两三年甚至更久时间。此外,虽然近年来中国内地药企在研发创新药方面进展迅速,但中国香港的这一传统新药引入机制往往因“对标”欧美,难以快速引入。当地在引入医疗器械方面的情况与之基本类似,同样缺乏特定法例规范管理相关产品的制造、进口、出口和销售。
在此方面,中国香港特区政府医卫局局长卢宠茂即曾提到,当地的前线医生其实知道一些中国内地研发的创新药物对病人确有帮助,“奈何有关药物未在中国香港注册,欲用无门”。
2023年,中国香港特区政府在当年的《施政报告》中对此有针对性地提出一项重点工作,即自主进行药械评审和注册。长远目标,则是设立第一层审批的国际药械权威机构,以及发展中国香港成为国际医疗创新枢纽。
按照中国香港特区政府卫生署透露的相关职能,为实现上述目标而成立的香港药械监管中心,将整合西药、中药及医疗器械的监管职能,通过优化药械监管,促进药械创新与研发。究其愿景,则是成为药物及医疗器械领域的国际权威监管机构。
按照其成立前后的相关工作规划,香港药械监管中心将分阶段推动第一层审批新药注册机制,初期会先处理风险较低的化学药延伸应用,之后再逐步扩展至各种生物药,目标是在2030年全面推行。
相关工作已从2023年底开始实施。按照当时香港卫生署引入的一种名为“1+”的审批机制,新药在当地的引入程序已开始部分简化,这也被认为有助于中国香港特区迈向第一层审批。
根据“1+”机制,新药如能提供符合要求的中国香港特区本地临床数据,并经本地专家认可后,只需再提交一个(而非原来的两个)外国药物监管机构的许可,便可在中国香港特区申请注册。该机制从2024年11月1日起已扩展至所有新药。
该机制生效至今,已有包括用于治疗癌症等危重疾病在内的11款新药获批注册,其中五款已纳入中国香港特区医管局药物名册。以药物价格为例,香港卫生署方面透露,部分获得“1+”机制审批的药物成本价下降30%。此外,该机制亦在提升地缘政治风险增加背景下供港药物的多样化。
中国香港特区政府卫生署署长林文健,则在解析相关机制的区别时透露,“1+”机制的含义是,如有新药希望在中国香港申请注册上市,首先需要拿到香港卫生署认可的国家或地区上市许可,“+”代表需要华人或香港本地临床数据证明药物在病人身上有效。
与之相比,“第一层审批”机制则无须要求药物在其他地方领取注册许可,只需要递交原始数据、三期临床数据即可申请(审批时效尚未确定),如此可让创新、有效药物马上来港。目前中国香港已在中成药、医疗器械方面实行“第一层审批”,但西药尚未执行该机制。
但其也透露,中国香港特区未来的药物审批机制将多线并行,即相关机制之间并非取代关系,“1+”机制及“第一层审批”乃至“第二层审批”之间共同进行,旨在加速药物审批。
按照香港卫生署助理署长(药物)陈凌峯透露的时间表,中国香港特区的西药“第一层审批”机制将会分成四个阶段实行,即在2026年从已注册化学药延伸应用开始,延伸到结构较复杂的已注册生物药延伸应用,扩展到非首创新药及特定先进疗法制品,最后在2030年落实于所有药物。
中国香港特区希望通过这一工作规划的逐步落地,让前述药械监管中心强化审批能力,逐渐获得国际性监管体系的认可。与之相应的时间跨度可能超过十年的各项工作,包括但不限于向国际医药法规协调会议(ICH)申请成为监管机构成员,并深化跨地域合作。2023年底,中国香港特区已以观察员身份加入ICH,并积极参与会议。
相关资料显示,该协调会议的宗旨是协调各成员的药品注册技术要求、制定各项涉及安全、效能及素质的国际最高标准的指导原则。其成员包括中国、美国、英国、瑞士等进行第一层审批国家或地区的药物监管机构。
整体而言,香港药械监管中心的成立,以及新药审批机制的积极引入,也被认为将在微观层面对粤港澳大湾区的联动式发展起到推动作用。
例如,对生物医药产业而言,如中国香港特区可建立起一条龙的药效安全审查流程,会有助于更多中国香港、中国内地乃至其他国家或地区的企业在港进行研发及临床试验。要达到药物研发目标,相关国际经验是主力两成靠大学、八成靠药企。
对此,中国香港立法会议员林顺潮则具体解析称,在“第一层审批”下中国香港可直接根据临床数据审批药物,吸引跨国药厂设研发中心或创建本地生物科技龙头企业,产业链从研发到商业化的完整发展。而国际药械经中国香港审查后,有机会经“港澳药械通”机制进入大湾区市场,中国内地药企亦能通过中国香港打入国际市场。
据《财经》获悉,2024年6月香港药械监管中心筹备办公室成立至今,其主要聚焦的工作内容即包括促进优质监管,以及加强与中国内地和国际合作等核心内容。相关工作的重点之所以如此选择,其背景之一是药物研究需要涉及大量病人临床数据,中国香港人口数量仅700余万,但粤港澳大湾区则是一个拥有近8600万人口的巨大市场及病例资源库。
深圳一位药物临床试验权威业内人士则对《财经》解析,中国香港近年来非常希望在大湾区内开展相关试验,“这不仅源于后者在成本和效率方面的优势很明显,此外内地医生亦有较为明显的优势,一是科研水平较高,二是手术类经验也较多。深港两地在开展联合临床试验方面的互补性较强”。
推动类似相关合作的机制,近年来正在逐渐建立。以深港之间的河套深港科技创新合作区为例,中国香港特区及深圳已分别成立“粤港澳大湾区国际临床试验所”和“粤港澳大湾区国际临床试验中心”,共同的作用是协作整合两地临床数据资源、推动跨境试验等。
以后者为例,6月27日,深圳医学科学院在河套举行粤港澳大湾区国际临床试验中心入驻仪式,标志着该中心进入实体化运作阶段。在机制创新方面,据粤港澳大湾区国际临床试验中心主任李镒冲透露,该中心依托河套“一区两园”优势,攻坚人员、样本及科研数据跨境流通便利化,推动“港澳药械通”真实世界数据用于中国内地注册申报试点。
李镒冲也向《财经》透露,该中心还将发挥河套合作区的政策优势和创新生态,加速创新生物医药和医疗器械临床试验进程,助力中国药、中国医疗装备走向国际市场。